
北京时间2022年5月18日,Nature在线发表了浙江大学“一带一路”国际医学院(筹)院长黄荷凤院士和中科院徐国良院士团队合作研究的最新成果:“Maternal inheritance of glucose intolerance via oocyte Tet3 insufficiency”。该研究发现了卵子源性糖尿病代际传递钥匙: Tet3(tet methylcytosine dioxygenase 3)。研究揭示了糖尿病患者卵母细胞内Tet3表达量普遍下调,受精后导致父本来源的促胰岛素分泌基因高度甲基化,从而抑制子代个体胰岛素分泌并诱发子代糖尿病。该项研究为人类认识和治疗糖尿病提供了崭新的科学视角。
全世界范围内约有2/5的糖尿病妇女处于育龄期,黄荷凤院士团队早期的研究结果证实了孕期宫内高糖等因素暴露能够改变DNA甲基化并造成代际间的遗传,同时还发现疾病遗传的起源可前推至孕前卵母细胞发育期,率先在国际上提出了“配子源性成人疾病”学说。然而配子或生殖细胞如何将不良环境因素传递给后代的作用机制还不清晰。在研究中,黄院士对卵源性糖尿病的发生机制进行了详细的解释。
首先,为了排除孕期和产后高糖环境干扰,研究人员首先利用链脲菌素(Streptozotocin)建立了高糖小鼠模型,从该小鼠获得卵母细胞后和正常雄鼠的精子进行体外受精,然后植入到正常的代孕母鼠子宫继续发育并产生后代。通过和对照组比较,糖尿病母鼠的子代在胚胎发育和幼崽大小上没有明显改变。但是伴随着年龄的增加,子代雄鼠和母鼠都逐渐显示出葡萄糖不耐的症状。研究结果还显示这种卵源性糖尿病是由胰岛素分泌不足引起,子代对胰岛素的敏感性并没有发生改变,而且只遗传给子一代。
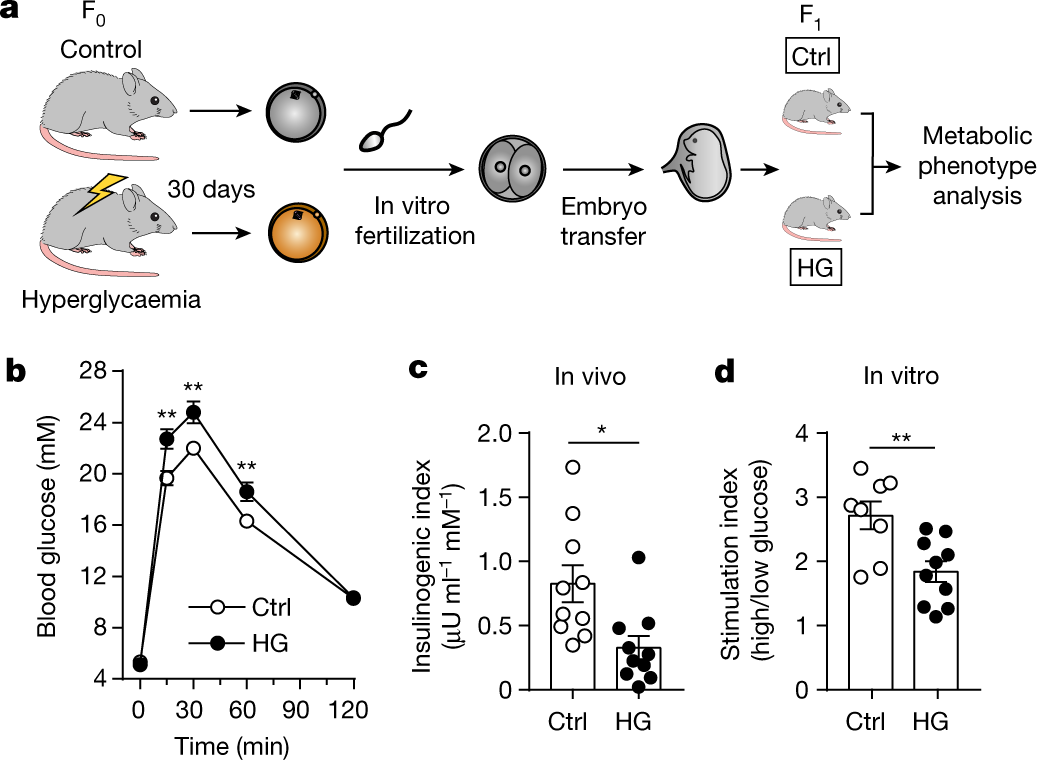
图一、孕前高血压导致后代葡萄糖不耐受
因为哺乳动物在传代时生殖细胞的全基因组甲基化图谱会重新编码,因此研究人员以全基因组甲基化图谱为切入点研究高糖暴露对卵母细胞的影响,发现高糖暴露的小鼠卵母细胞中TET3基因的转录水平减少了大约50%。
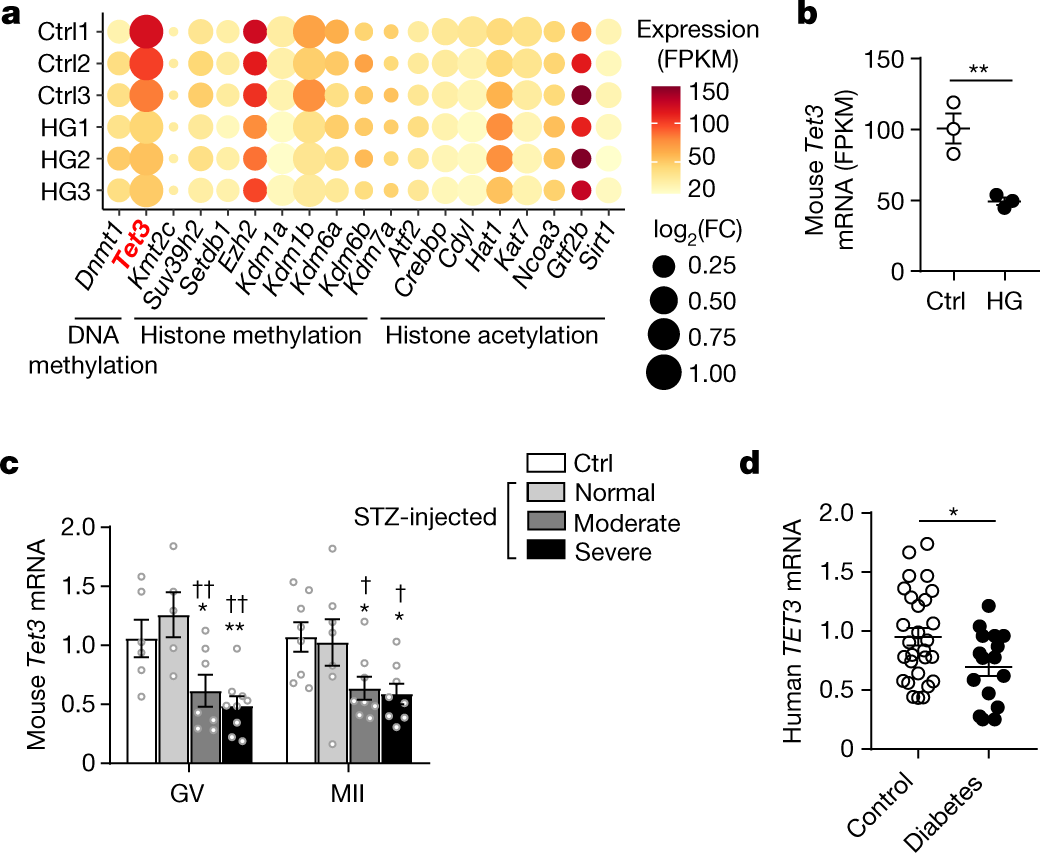
图二、TET3基因在高糖小鼠模型(HG)的和高血压病人卵母细胞表达下调
在卵母细胞中,TET3基因是唯一一个DNA 5-甲基胞嘧啶修饰酶,催化5-甲基胞嘧啶(5mc)到5-羟甲基胞嘧啶的转变(5hmC),受精卵时期在DNA去甲基化方面发挥关键作用。研究人员发现高糖暴露的母鼠卵母细胞受精后不仅TET3基因表达下调,同时还伴随基因组中5hmC /5mC比率下降。因此研究人员得出结论: TET3表达下调影响了受精卵DNA的去甲基化程度。
那么是卵母细胞内葡萄糖升高含量抑制了TET3表达吗?研究人员发现TET3基因表达的下调和葡萄糖的含量存在正相关的关系,在高糖小鼠模型的卵母细胞内葡萄糖含量越高,TET3基因表达的下调越明显。这种现象在人体内也得到证实,高血压妇女卵母细胞的葡萄糖含量升高,同时伴随TET3基因的表达下调。
那么受精卵DNA去甲基化受阻影响了哪些基因的表达呢? 研究人员发现高血糖暴露引起的基因组强甲基化主要集中在胰岛素分泌相关基因上,这和一开始观测到的高糖小鼠模型的子代胰岛细胞胰岛素分泌缺失的现象一致。
GCK基因编码限速酶葡萄糖激酶,调控胰岛素分泌, 在胰岛b细胞中是葡萄糖感应机器的一个重要组成部分。研究人员以GCK基因为例子研究了高糖暴露卵母细胞的启动子区域高度甲基化的模式。正常条件下,小鼠受精卵中雄原核的GCK基因启动子区域会被Tet3去甲基化,但是在高糖暴露情况下,GCK基因启动子区域的依然保持强甲基化状态。研究人员一直追踪到了子代出生后第16周,GCK基因启动子区域强甲基化状态依然存在。伴随着GCK基因启动子区域强甲基化,GCK基因的转录水平降低。这一现象在高血压病人卵母细胞和受精卵中也得到证实。
研究人员也追踪了胰岛素分泌相关基因启动子区域强甲基化的来源,发现包括GCK在内,Rapgef4, Gna11 and Prkca等基因的启动子区域的高度甲基化都来源于受精卵的雄原核。
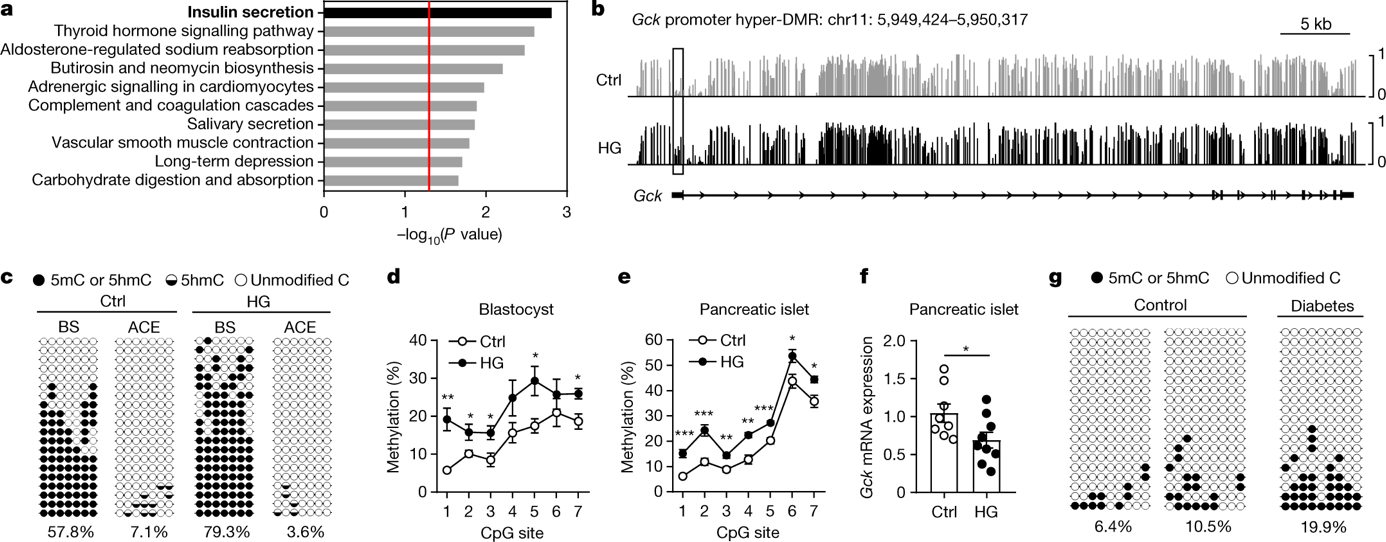
图三、孕前高血糖改变高糖小鼠模型过的子代和人胚囊胰岛素分泌相关基因的甲基化
为了进一步验证GCK启动子区域的高甲基化由下调的Tet3表达引起,研究人员进一步在正常母鼠体内敲除TET3基因,发现其卵母细胞受精后保持GCK启动子区域的高甲基化。在高血糖母鼠的卵母细胞注射Tet3 mRNA,受精后发现其雄原核GCK启动子区域的高甲基化程度降低,并伴随GCK表达量上调,出生的子代对葡萄糖也更加耐受。
最终研究人员得出结论,高糖暴露导致卵母细胞内Tet3表达量下调,Tet3表达量下调导致卵母细胞受精后不能对父本来源的胰岛素相关等位基因基因去甲基化,例如GCK基因,从而干扰子代胰岛素相关基因表达,阻碍子代胰岛素分泌,引起子代葡萄糖不耐受。
全文链接:
https://www.nature.com/articles/s41586-022-04756-4
2025年9月16日,一场聚焦区域医疗科研合作的座谈会在浙江大学国际健康医学研究院成功举办,义乌市科技局、卫健局、双江湖...
2022年7月5日,浙江大学国际健康医学研究院公共实验平台重新改建后,正式投入使用。浙江大学国际健康医学研究院公共技术平台成立...